
-
位置:首頁 >> 所有產(chǎn)品 >> 鹽酸右美托咪定注射液說明書
所有產(chǎn)品
鹽酸右美托咪定注射液說明書
(僅供內(nèi)部學(xué)習(xí)使用)
【藥品名稱】
通用名稱:鹽酸右美托咪定注射液
英文名稱:Dexmedetomidine Hydrochloride Injection
漢語拼音:Yansuan Youmeituomiding Zhusheye
【成份】
本品主要成份為鹽酸右美托咪定。
化學(xué)名稱:(+)-4-(S)-[1-(2,3-二甲基苯基)-乙基]-1H-咪唑鹽酸鹽。

分子式:C13H16N2·HCl
分子量:236.74
輔料:氯化鈉、注射用水
【性狀】
本品為無色或幾乎無色的澄明液體。
【適應(yīng)癥】用于行全身麻醉的手術(shù)患者氣管插管和機(jī)械通氣時(shí)的鎮(zhèn)靜。用于重病監(jiān)護(hù)治療期間開始插管和使用呼吸機(jī)病人的鎮(zhèn)靜,本品連續(xù)輸注不可超過24h。
【規(guī)格】按C13H16N2計(jì)(1)1ml:0.1mg(2)2ml:0.2mg
【用法用量】成人劑量:配成4μg/ml濃度以1μg/kg劑量緩慢靜注,輸注時(shí)間超過10分鐘。隨后以0.2~0.7μg/kg/hr維持輸注。維持劑量的輸注速率應(yīng)調(diào)整至獲得期望的鎮(zhèn)靜效果。配制方法:本品在給藥前必須用0.9%的氯化鈉溶液稀釋達(dá)濃度4μg/ml,可取出1ml本品加入24ml 0.9%的氯化鈉注射液中形成總的25ml溶液,輕輕搖動(dòng)使均勻混合;也可取出2ml本品加入48ml 0.9%的氯化鈉注射液中形成總的50ml溶液,輕輕搖動(dòng)使均勻混合。操作過程中必須始終保持嚴(yán)格的無菌操作。一般地,靜脈用藥前應(yīng)該肉眼檢查藥品有無顆粒物質(zhì)和顏色是否改變。劑量調(diào)整:由于可能的藥效學(xué)相互作用,當(dāng)本品與其他麻醉劑、鎮(zhèn)靜劑、安眠藥或阿片類藥物同時(shí)給藥時(shí)可能需要減少給藥劑量(見藥物相互作用)。肝、腎功能損傷的患者和老年患者可能需要考慮減少給藥劑量。藥品相容性:因?yàn)槲锢硐嗳菪陨胁淮_定,本品不應(yīng)與血液或血漿通過同一靜脈導(dǎo)管同時(shí)給予。當(dāng)本品與以下藥物同時(shí)給予時(shí)顯示不相容:兩性霉素B,地西泮。當(dāng)本品與以下靜脈液體和藥物同時(shí)給予時(shí)已經(jīng)顯示了相容性:0.9%氯化鈉注射液,5%葡萄糖注射液,20%甘露醇注射液,乳酸鈉林格注射液。已經(jīng)證實(shí)一些類型的天然橡膠可能吸收本品,建議使用合成的或有涂層的橡膠墊給藥裝置。建議選用HDPE與TPE材質(zhì)的輸液管,禁用TPU材質(zhì)的輸液管。
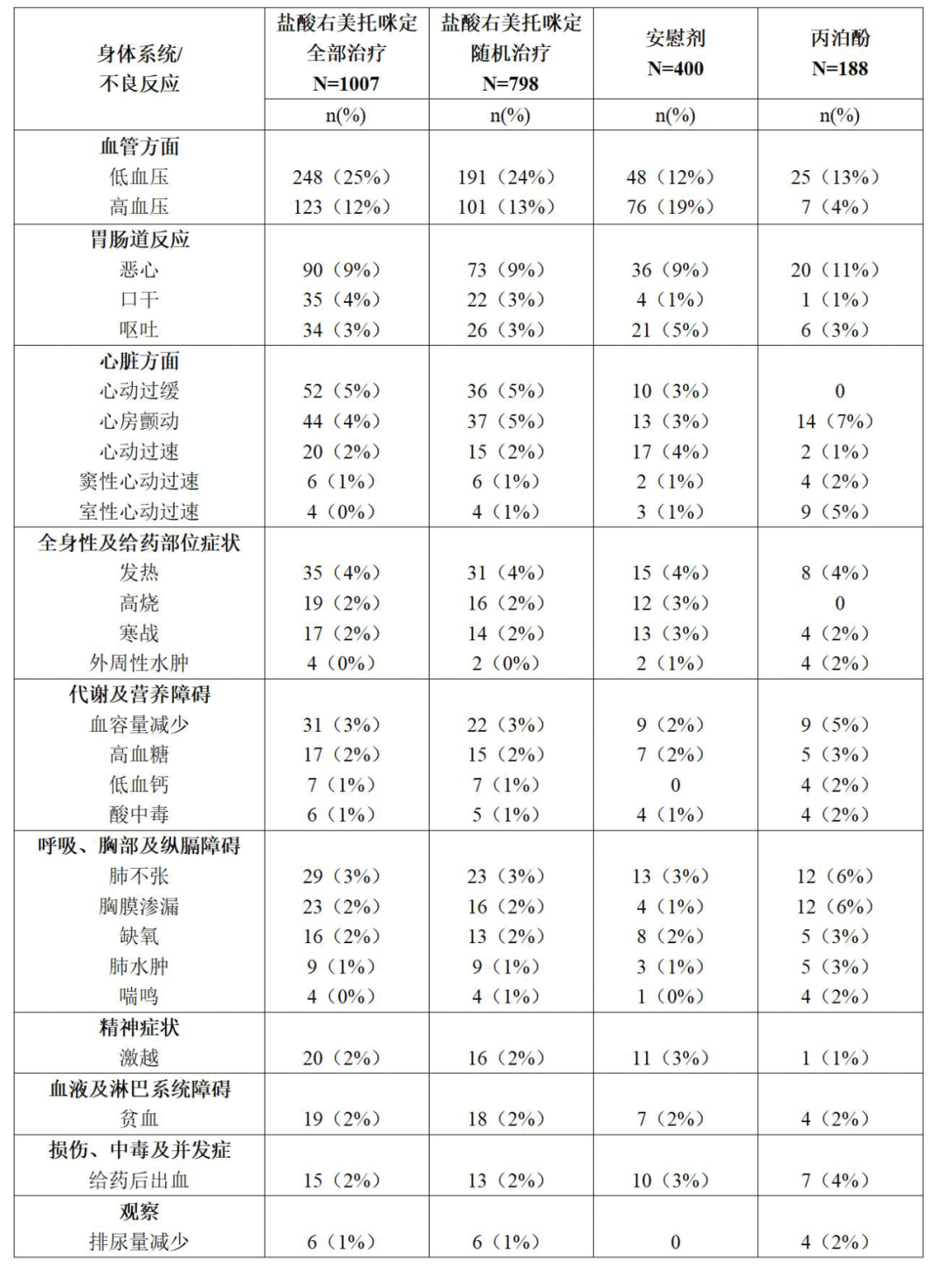
【不良反應(yīng)】由于臨床試驗(yàn)是在多種不同情況下進(jìn)行的,因此一種藥物在臨床試驗(yàn)中觀察到的不良反應(yīng)發(fā)生率不能與另一種藥物進(jìn)行直接比較,而且可能無法反映實(shí)際臨床應(yīng)用中觀察到的不良反應(yīng)情況。國外研究報(bào)道使用鹽酸右美托咪定注射液與以下嚴(yán)重不良反應(yīng)有關(guān):● 低血壓、心動(dòng)過緩及竇性停搏(見注意事項(xiàng))● 暫時(shí)性高血壓(見注意事項(xiàng))國外研究報(bào)道與治療相關(guān)的發(fā)生率大于2%的最常見不良反應(yīng)為低血壓、心動(dòng)過緩及口干。以下(包括上市后情況)為國外臨床研究中發(fā)生的不良反應(yīng)情況:重癥監(jiān)護(hù)室(ICU)的鎮(zhèn)靜不良反應(yīng)信息來源于重癥監(jiān)護(hù)室的1007例患者接受持續(xù)輸注鹽酸右美托咪定注射液鎮(zhèn)靜的試驗(yàn)。平均總劑量為7.4μg/kg(范圍:0.8~84.1),每小時(shí)平均劑量為0.5μg/kg/hr(范圍:0.1~6.0),平均輸注時(shí)間為15.9小時(shí)(范圍:0.2~157.2)。試驗(yàn)人群在17至88歲之間,43%≥65歲,男性占77%,93%為高加索人。表1為發(fā)生率>2%的藥物不良反應(yīng)。最常見的不良反應(yīng)為低血壓、心動(dòng)過緩及口干。
表1:發(fā)生率>2%的不良反應(yīng)——重癥監(jiān)護(hù)室鎮(zhèn)靜的受試人群
不良反應(yīng)信息源自于兩項(xiàng)程序鎮(zhèn)靜的試驗(yàn),這兩項(xiàng)試驗(yàn)中共有318例患者接受了鹽酸右美托咪定注射液(Precedex)治療。平均總劑量為1.6μg/kg(范圍:0.5~6.7),每小時(shí)平均劑量為1.3μg/kg/hr(范圍:0.3~6.1),平均輸注時(shí)間為1.5小時(shí)(范圍:0.1~6.2)。試驗(yàn)人群在18至93歲之間,30%的患者≥65歲,男性占52%,61%為高加索人。程序鎮(zhèn)靜:
表2為發(fā)生率>2%的藥物不良反應(yīng)。最常見的不良反應(yīng)為低血壓、心動(dòng)過緩及口干。表中的腳注為生命體征指標(biāo)報(bào)告為不良反應(yīng)的預(yù)先設(shè)定標(biāo)準(zhǔn)。兩項(xiàng)試驗(yàn)中患者呼吸速率下降和缺氧的發(fā)生率在鹽酸右美托咪定注射液給藥組和對(duì)照組均相似。
表2:發(fā)生率>2%的不良反應(yīng)——程序鎮(zhèn)靜的受試人群
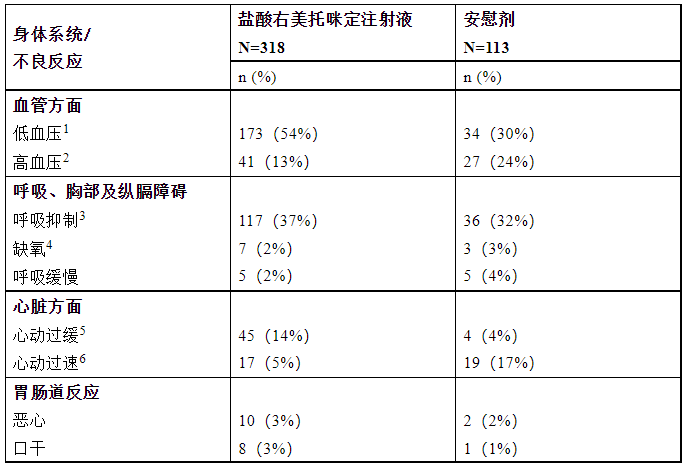
1、低血壓的絕對(duì)和相對(duì)定義為:收縮壓<80mmHg或比試驗(yàn)藥物輸注前值低30%以下,或舒張壓<50mmHg。2、高血壓的絕對(duì)和相對(duì)定義為:收縮壓>180mmHg或比試驗(yàn)藥物輸注前值高30%以上,或舒張壓>100mmHg。3、呼吸抑制的絕對(duì)和相對(duì)定義為呼吸頻率<每分鐘8次或比基線下降了25%以上。4、缺氧的絕對(duì)和相對(duì)定義為SpO2<90%或比基線減少了10%。5、心動(dòng)過緩的絕對(duì)和相對(duì)定義為每分鐘心跳次數(shù)<40或比輸注前值低30%以下。6、心動(dòng)過速的絕對(duì)和相對(duì)定義為每分鐘心跳次數(shù)>120或比輸注前值高30%以上。上市后情況:下列不良反應(yīng)是鹽酸右美托咪定注射液獲準(zhǔn)上市后觀察到的。由于這些不良反應(yīng)是由樣本人數(shù)尚不明確的用藥人群自發(fā)報(bào)告的,因此不能確切地估計(jì)其發(fā)生頻率和確定與藥物的因果關(guān)系。
低血壓和心動(dòng)過緩是鹽酸右美托咪定注射液獲準(zhǔn)上市后最常見的不良反應(yīng)。
表3:鹽酸右美托咪定注射液上市后出現(xiàn)的不良反應(yīng)

【禁忌】對(duì)本品及其成份過敏者禁用。
【注意事項(xiàng)】本品只能由專業(yè)人士在具備醫(yī)療監(jiān)護(hù)設(shè)備的條件下使用。由于本品的已知藥理作用,患者輸注本品時(shí)應(yīng)該進(jìn)行連續(xù)監(jiān)測(cè)。低血壓、心動(dòng)過緩和竇性停搏 有報(bào)道迷走神經(jīng)張力高的或不同給藥方式(如快速靜脈注射或推注)的健康青年志愿者給予本品后發(fā)生臨床明顯的心動(dòng)過緩和竇性停搏。
有報(bào)道血壓過低和心動(dòng)過緩與本品灌輸有關(guān)。如果需要醫(yī)藥救治,治療可能包括減少或停止本品輸注,增加靜脈液體的流速,抬高下肢,以及使用升高血壓的藥物。因?yàn)楸酒酚锌赡芗觿∶宰呱窠?jīng)刺激引起的心動(dòng)過緩,臨床醫(yī)生應(yīng)該做好干預(yù)的準(zhǔn)備。應(yīng)該考慮靜脈給予抗膽堿能藥物(例如,格隆溴銨、阿托品)來減輕迷走神經(jīng)的緊張性。在臨床試驗(yàn)中,阿托品或格隆溴銨在治療本品引起的大多數(shù)心動(dòng)過緩事件中有效。然而,在一些有明顯的心血管功能不良的患者中,要求更進(jìn)一步的急救手段。
當(dāng)對(duì)有晚期心臟傳導(dǎo)阻滯和/或嚴(yán)重的心室功能不全的患者給予本品時(shí)應(yīng)該小心謹(jǐn)慎。因?yàn)楸酒方档土私桓猩窠?jīng)系統(tǒng)活性,在血容量過低、糖尿病或慢性高血壓以及老年患者中可能預(yù)期會(huì)發(fā)生更多的血壓過低和/或心動(dòng)過緩。
當(dāng)給予其他血管擴(kuò)張劑或負(fù)性頻率作用藥物時(shí),同時(shí)給予本品可能有附加的藥效影響,應(yīng)該謹(jǐn)慎給藥。一過性高血壓出現(xiàn)一過性高血壓主要在負(fù)荷劑量期間觀察到,與本品的外圍血管收縮作用有關(guān)。一過性高血壓通常不需要治療,然而降低負(fù)荷輸注速度可能是理想的。 覺醒力一些給予本品的患者當(dāng)受到刺激時(shí)可觀察到是覺醒的和警覺的。在沒有其他臨床體征和癥狀的情況下,僅此一項(xiàng)不應(yīng)該被認(rèn)為是缺乏療效的證據(jù)。 停藥癥狀重癥監(jiān)護(hù)室的鎮(zhèn)靜:如果本品給藥超過24小時(shí)并且突然停止,可能導(dǎo)致與報(bào)道的另一種α2腎上腺素藥可樂定相似的停藥癥狀。這些癥狀包括緊張、激動(dòng)和頭疼,伴隨或跟隨著血壓迅速的升高和血漿中兒茶酚胺濃度的升高。
程序鎮(zhèn)靜:短期輸注本品(<6小時(shí))停藥后未出現(xiàn)停藥癥狀。
肝臟損傷
由于右美托咪定的清除率隨著肝臟損傷的嚴(yán)重程度下降,對(duì)于肝臟功能損傷的患者應(yīng)該考慮降低劑量。
依賴性
右美托咪定在人體中的潛在依賴性還沒有研究。然而,由于在嚙齒動(dòng)物和靈長(zhǎng)類動(dòng)物中的研究已經(jīng)證明右美托咪定與可樂定具有相似的藥理學(xué)作用,突然中止本品可能產(chǎn)生可樂定樣的停藥癥狀。
耐受性和快速抗藥反應(yīng)
使用右美托咪定超過24小時(shí)與耐受性和快速抗藥反應(yīng)有關(guān),且可增加劑量相關(guān)不良反應(yīng)。
【孕婦及哺乳期婦女用藥】在孕婦未進(jìn)行充分良好的臨床研究。右美托咪定只有在潛在的好處大于對(duì)胎兒潛在的危險(xiǎn)時(shí)才可以在孕婦使用。
本品對(duì)待產(chǎn)和生產(chǎn)孕婦的安全性尚未研究。因此,在待產(chǎn)和生產(chǎn)期間包括剖腹產(chǎn)術(shù)時(shí)不推薦本品。
尚不知道本品是否分泌到人乳中。放射性同位素示蹤的右美托咪定皮下給予哺乳的雌鼠后在乳汁中分泌。因?yàn)樵S多藥物在人乳中分泌,哺乳期婦女應(yīng)當(dāng)慎用本品。
【兒童用藥】本品在18歲以下的兒童患者的安全性和有效性尚不明確。因此,本品不推薦用于這些人群。
【老年用藥】已知右美托咪定主要通過腎臟排泄,該藥在腎功能損傷的病人中發(fā)生不良反應(yīng)的危險(xiǎn)性更大。年老的病人腎功能降低,因此對(duì)年老的病人應(yīng)當(dāng)謹(jǐn)慎選擇劑量,并且監(jiān)測(cè)腎功能可能是有用的。
國外臨床研究中,重癥監(jiān)護(hù)室鎮(zhèn)靜試驗(yàn)中共有729例患者≥65歲,200例患者≥75歲。65歲以上患者中,給予本品后心動(dòng)過緩和低血壓的發(fā)生率較高。因此65歲以上患者使用本品時(shí)需考慮降低劑量。程序鎮(zhèn)靜的臨床試驗(yàn)中共有131例患者≥65歲,47例患者≥75歲。低血壓的發(fā)生率65歲或以上為72%、75歲或以上為74%,65歲以上患者為47%。因此65歲以上患者使用本品時(shí)應(yīng)當(dāng)減少負(fù)荷劑量,建議以0.5μg/kg,輸注10分鐘以上。
【藥物相互作用】麻醉劑/鎮(zhèn)靜劑/催眠藥/阿片類同時(shí)給予本品和麻醉劑、鎮(zhèn)靜劑、催眠藥和阿片類可能導(dǎo)致各自藥理作用的增強(qiáng)。國外研究報(bào)道已經(jīng)確定了鹽酸右美托咪定與七氟烷、異氟烷、丙泊酚、阿芬太尼和咪達(dá)唑侖的影響。右美托咪定和異氟烷、丙泊酚、阿芬太尼和咪達(dá)唑侖之間沒有藥動(dòng)學(xué)相互作用。然而,由于可能的藥效學(xué)相互作用,當(dāng)同時(shí)給予本品時(shí),可能要求降低本品或伴隨的麻醉劑、鎮(zhèn)靜劑、催眠藥和阿片類藥物的劑量。
神經(jīng)肌肉的阻斷
在一項(xiàng)對(duì)于10個(gè)健康志愿者的國外研究中,鹽酸右美托咪定給藥45分鐘,血漿濃度為1ng/ml時(shí)沒有導(dǎo)致與羅庫溴銨給藥相關(guān)的神經(jīng)肌肉阻斷程度的明顯增加。
【藥物過量】國外資料顯示:在一項(xiàng)耐受性臨床研究中,對(duì)健康志愿者給予鹽酸右美托咪定劑量達(dá)到或超過了0.2~0.7μg/kg/hr,達(dá)到的最大血漿濃度大約是治療范圍上限的13倍。在達(dá)到最高劑量的兩個(gè)受試者中觀察到的最顯著的影響是一度房室傳導(dǎo)阻滯和二度心臟傳導(dǎo)阻滯,隨后房室傳導(dǎo)阻滯和心臟傳導(dǎo)阻滯在一分鐘內(nèi)自然消除,未發(fā)現(xiàn)血液動(dòng)力學(xué)的影響。
在重癥監(jiān)護(hù)病房的鎮(zhèn)靜研究中5例患者過量接受了鹽酸右美托咪定。這些患者中2例沒有癥狀報(bào)告;一例患者接受了2μg/kg負(fù)荷劑量10分鐘(推薦負(fù)荷劑量的兩倍),一例患者接受了0.8μg/kg/hr的維持輸注劑量。其他兩例接受2μg/kg負(fù)荷劑量10分鐘的患者出現(xiàn)心動(dòng)過緩和/或低血壓。一例接受推注未稀釋的鹽酸右美托咪定負(fù)荷劑量(19.4μg/kg)的患者出現(xiàn)心跳停止,并得到成功救治。
【藥理毒理】藥理作用右美托咪定是一種相對(duì)選擇性α2-腎上腺素受體激動(dòng)劑,具有鎮(zhèn)靜作用。動(dòng)物緩慢靜脈輸注右美托咪定10~300μg/kg時(shí)可見對(duì)α2-腎上腺素受體的選擇性作用,但在較高劑量下(≥1000μg/kg)緩慢靜脈輸注或快速靜脈注射給藥時(shí)對(duì)α1和α2-受體均有作用。毒理研究遺傳毒性右美托咪定Ames試驗(yàn)、小鼠淋巴瘤細(xì)胞試驗(yàn)結(jié)果為陰性。右美托咪定體外人淋巴細(xì)胞染色體畸變?cè)囼?yàn)在大鼠S9代謝活化條件下結(jié)果為陽性,但在無大鼠S9代謝活化條件下結(jié)果為陰性,在有或無人S9代謝活化條件下結(jié)果均為陰性。NMRI小鼠體內(nèi)微核試驗(yàn)結(jié)果為陽性,而CD-1小鼠體內(nèi)微核試驗(yàn)結(jié)果為陰性。生殖毒性雄性或雌性大鼠自交配前分別10周和3周直至交配期間,每日皮下注射給予右美托咪定劑量高達(dá)54μg/kg(根據(jù)體表面積計(jì)算,低于最大推薦人體靜脈注射給藥劑量)未見對(duì)生育力的影響。
大鼠于妊娠第5~16天皮下注射給予右美托咪定劑量高達(dá)200 ?g/kg(以體表面積計(jì),約相當(dāng)于人靜脈注射最大推薦劑量)、兔于妊娠第6~18天皮下注射劑量高達(dá)96 ?g/kg(以血漿藥物AUC計(jì),約為人靜脈注射最大推薦劑量暴露量的一半),未見致畸作用。但是,大鼠在皮下注射劑量為200 ?g/kg時(shí)可見胎仔毒性,表現(xiàn)為著床后丟失增加、活胎數(shù)減少,無影響劑量為20 ?g/kg(以體表面積計(jì),低于人靜脈注射最大推薦劑量)。
大鼠自妊娠第16天至哺乳期皮下注射右美托咪定,劑量為8、32 ?g/kg(以體表面積計(jì),低于人靜脈注射最大推薦劑量)時(shí)子代體重減輕,32 ?g/kg劑量組F2代還可見胚胎與胎仔毒性,以及運(yùn)動(dòng)發(fā)育遲滯。
妊娠大鼠皮下注射給予放射性標(biāo)記的右美托咪定,可見胎盤轉(zhuǎn)運(yùn)。其他犬單次給予右美托咪定,對(duì)促腎上腺皮質(zhì)激素(ACTH)刺激的皮質(zhì)醇反應(yīng)無明顯影響;但是,犬連續(xù)皮下輸注鹽酸右美托咪定3、10μg/kg/h一周后(暴露量估計(jì)在臨床暴露量范圍內(nèi)),ACTH刺激的皮質(zhì)醇反應(yīng)比生理鹽水對(duì)照組分別減少約27%和40%,提示劑量依賴性腎上腺抑制。
【藥代動(dòng)力學(xué)】國外研究資料顯示:在健康志愿者(N=10)的研究中,當(dāng)靜脈輸注劑量范圍為0.2~0.7μg /kg/hr時(shí),呼吸率和氧飽和度保持在正常范圍內(nèi),未見呼吸抑制。
靜脈輸注后,右美托咪定的藥代動(dòng)力學(xué)參數(shù)如下:快速分布相的分布半衰期(t1/2)大約為6分鐘;終末清除半衰期(t1/2)大約為2小時(shí);穩(wěn)態(tài)分布容積(Vss)大約為118升。清除率大約為39L/h。評(píng)價(jià)清除率的平均體重為72kg。
靜脈輸注本品0.2~0.7μg/kg/hr直到24小時(shí)右美托咪定呈現(xiàn)線性動(dòng)力學(xué)。表4列出了(在接受適當(dāng)?shù)呢?fù)荷劑量后)分別持續(xù)12和24小時(shí)輸注鹽酸右美托咪定0.17μg/kg/hr(目標(biāo)濃度為0.3ng/ml)、24小時(shí)輸注0.33μg/kg/hr(目標(biāo)濃度為0.6ng/ml)和24小時(shí)輸注0.70μg/kg/hr(目標(biāo)濃度為1.25ng/ml)后的主要藥代動(dòng)力學(xué)參數(shù)。表4. 藥代動(dòng)力學(xué)參數(shù)Mean±SD

作為調(diào)和平均值和偽擬標(biāo)準(zhǔn)差。#Avg Css=右美托咪定的平均穩(wěn)態(tài)濃度。(12小時(shí)輸注的2.5~9小時(shí)取樣,24小時(shí)輸注的2.5~18小時(shí)取樣)。分布:右美托咪定的穩(wěn)態(tài)分布容積(Vss)大約為118升。在正常健康男性和女性志愿者的血漿中對(duì)右美托咪定的蛋白結(jié)合進(jìn)行了評(píng)價(jià)。在不同的濃度試驗(yàn)中其平均蛋白結(jié)合率為94%;男性和女性的蛋白結(jié)合率相似。與健康受試者相比,肝損傷受試者右美托咪定與血漿蛋白結(jié)合的功能明顯下降。
體外研究觀察了芬太尼、酮咯酸、茶堿、地高辛和利多卡因取代右美托咪定結(jié)合蛋白的可能,結(jié)果未觀察到右美托咪定血漿蛋白結(jié)合率的改變。體外又研究了苯妥英鈉、華法林、布洛芬、普萘洛爾、茶堿和地高辛的蛋白結(jié)合被右美托咪定取代的可能,結(jié)果表明沒有藥物的蛋白結(jié)合似乎被右美托咪定明顯取代。
代謝:右美托咪定幾乎完全被生物轉(zhuǎn)化,極少以原形從尿和糞便中排出。生物轉(zhuǎn)化包括直接葡萄苷酸化和細(xì)胞色素P450介導(dǎo)的代謝。右美托咪定的主要代謝途徑是:直接N-葡萄苷酸化成非活性代謝產(chǎn)物;脂肪羥基化作用(主要由CYP2A6介導(dǎo))產(chǎn)生3-羥基右美托咪定、3-羥基右美托咪定葡糖苷酸和3-羧基右美托咪定;右美托咪定N-甲基化產(chǎn)生3-羥基N-甲基右美托咪定、3-羧基N-甲基右美托咪定和N-甲基-O-葡糖苷酸右美托咪定。清除:右美托咪定的終末清除半衰期(t1/2)大約為2小時(shí),清除率大約為39L/h。質(zhì)量平衡研究證實(shí)靜脈輸注放射性標(biāo)記的右美托咪定9天后平均95%的放射活性物質(zhì)從尿中回收,4%在糞便中。尿中可以檢測(cè)到右美托咪定原形。輸注本品后24小時(shí)內(nèi)大約85%的放射活性物質(zhì)從尿中排出。尿中排出的放射活性物質(zhì)分段分離證實(shí)為N-葡萄苷酸化產(chǎn)物占34%。另外,脂肪羥基化作用產(chǎn)物3-羥基右美托咪定、3-羥基右美托咪定葡糖苷酸和3-羧酸右美托咪定大約占14%。右美托咪定N-甲基化產(chǎn)生的3-羥基N-甲基右美托咪定、3-羧基N-甲基右美托咪定和N-甲基O-葡糖苷酸右美托咪定大約占18%。N-甲基代謝產(chǎn)物本身是次要循環(huán)成分,在尿中未檢測(cè)到。大約28%的尿代謝物未被識(shí)別。
性別:右美托咪定的藥代動(dòng)力學(xué)未觀察到性別差異。
老年患者:右美托咪定的藥代動(dòng)力學(xué)特性不隨年齡而改變。年輕(18~40歲)、中年(41~65歲)和老年(>65歲)受試者中右美托咪定的藥代動(dòng)力學(xué)無差異。
兒科患者:右美托咪定在兒科患者的藥代動(dòng)力學(xué)特性未被研究。
肝功能損傷:在不同程度肝功能損傷受試者(Child-Pugh分類A、B或C),右美托咪定的清除率值比健康受試者低。輕、中和重度肝功能損傷受試者的平均清除率值分別為正常健康受試者的74%、64%和53%,游離藥物的平均清除率分別為正常健康受試者的59%、51%和32%。
盡管本品給藥需達(dá)到效果,但是肝功能損傷患者或許需要考慮減少給藥劑量(見用法用量、注意事項(xiàng))。
腎功能損傷:嚴(yán)重腎功能損傷受試者(肌酐清除率:<30ml/min)右美托咪定的藥代動(dòng)力學(xué)(Cmax、Tmax、AUC、t1/2、CL和Vss)與健康受試者相比無明顯差異。但是,腎功能損傷患者右美托咪定代謝物的藥代動(dòng)力學(xué)未被評(píng)價(jià)。因?yàn)榇蠖鄶?shù)代謝物從尿中排出,腎功能損傷患者長(zhǎng)期輸注很可能造成代謝物蓄積(見用法用量)。藥物相互作用體外研究:人肝微粒體的體外研究表明沒有證據(jù)顯示細(xì)胞色素P450介導(dǎo)的藥物相互作用可能具有臨床相關(guān)性。
【貯藏】不超過30℃密閉保存。
【包裝】中硼硅玻璃管制注射劑瓶、注射液用局部覆聚四氟乙烯膜氯化丁基橡膠塞,5支/盒;10支/盒。
【有效期】18個(gè)月
【執(zhí)行標(biāo)準(zhǔn)】
【批準(zhǔn)文號(hào)】
(1)1ml:0.1mg(按C13H16N2計(jì))國藥準(zhǔn)字H20227103
(2)2ml:0.2mg(按C13H16N2計(jì))國藥準(zhǔn)字H20213093
【生產(chǎn)企業(yè)】企業(yè)名稱:海南中玉藥業(yè)有限公司生產(chǎn)地址:海南省定安塔嶺工業(yè)區(qū)塔中路




